Наше генетическое наследие – это не просто набор инструкций, зашифрованных в последовательности нуклеотидов. Это сложная система, где надпись на ДНК дополнительно маркируется особыми “метками” – метилирующими группами. Эти метки, подобно ярлыкам, регулируют активность генов, определяя, какие из них будут читаться и выполнять свои функции в каждой клетке организма.
Эпигенетические переключатели
Представьте себе организм как огромный оркестр. ДНК – это партитура, а метилирование – дирижер, который указывает музыкантам (протеинам), когда и какие ноты играть. Благодаря этому, одна и та же музыкальная тема (ген) может звучать по-разному в разных частях тела: в мозге, сердце, мышцах. Именно эпигенетические модификации, такие как метилирование, обеспечивают эту тонкую настройку.
Но эта система не статична. Метки на ДНК могут меняться со временем под влиянием внешних факторов и внутренних процессов. И когда эти метки теряют свою точность, возникают проблемы – болезни, в том числе редкие генетические расстройства.
Синдром ICF: головоломка метилирования
Одним из таких заболеваний является синдром иммунодефицита, нестабильности центромеры и лицевых аномалий (ICF). Он проявляется рецидивирующими инфекциями, необычными чертами лица, задержкой роста и когнитивных способностей. Долгое время ученые знали, что мутации в гене CDCA7 лежат в основе ICF, но механизм его действия оставался загадкой.
CDCA7 – двойной датчик гемиметилирования
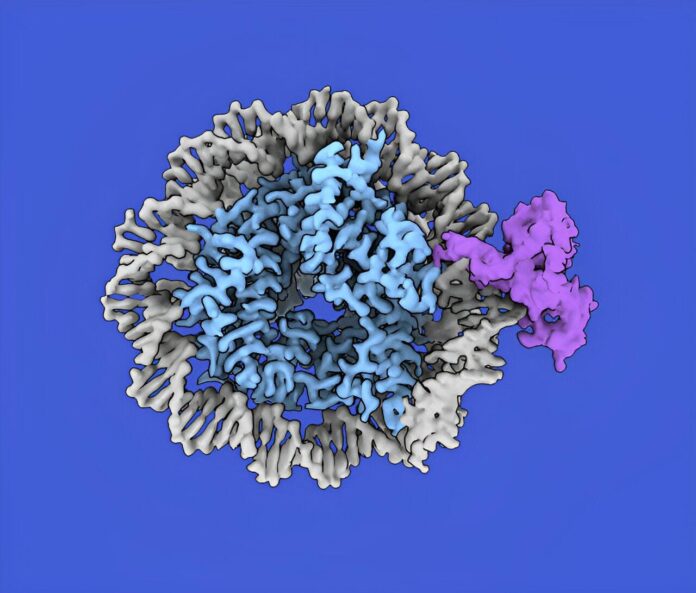
Теперь исследователи из лаборатории Рокфеллеровского университета в Фунабики, совместно с коллегами из Токийского и городского университета Йокогамы, совершили важное открытие. Они обнаружили, что CDCA7 – это не просто участник процесса метилирования, а настоящий “сенсор гемиметилирования”.
Гемиметилирование – это временное состояние ДНК после репликации, когда одна из двух дочерних нитей еще не получила свою полную порцию метильных меток. Это как полуготовый рисунок, где половина деталей уже нарисована, а другая ждет своего часа. Долгое время считалось, что распознавание гемиметилирования осуществляет исключительно белок UHRF1.
Но CDCA7, оказывается, тоже умеет это делать! Это открытие, опубликованное в журнале Science Advances, перевернуло представление о механизмах эпигенетического контроля.
CDCA7 и тайна хроматина
Ключом к пониманию роли CDCA7 стала связь с белком HELLS, мутации которого также приводят к синдрому ICF. HELLS – это “ремоделер нуклеосом”, молекулярный инструмент, который может временно раздвигать ДНК от ее упаковки в компактные структуры – нуклеосом.
Представьте хроматин как сложную библиотеку, где книги (ДНК) аккуратно уложены на полках (нуклеосомы). CDCA7-HELLS комплекс словно опытный библиотекарь, который может открыть нужную книгу (гемиметилированную ДНК), чтобы UHRF1 смог прочесть ее метки и активировать метилирование.
Это открытие объясняет, почему клетке нужны два датчика гемиметилирования: CDCA7 специализируется на распознавании меток в плотной структуре хроматина, где UHRF1 не так эффективно действует. Это как различие между поиском информации в упорядоченной библиотеке и в заваленной коробке – для каждой задачи нужен свой подход.
На пути к новым открытиям
Понимание роли CDCA7 в эпигенетическом контроле открывает новые горизонты для исследований. Теперь ученые могут глубже изучать механизмы, лежащие в основе заболеваний, вызванных сбоями метилирования ДНК, и разрабатывать более точные терапевтические подходы.
А возможно, CDCA7 хранит еще больше секретов, которые помогут нам расшифровать сложную азбуку эпигенетики и раскрыть тайны самого себя.